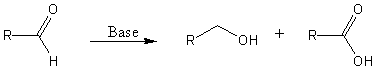A Cannizzaro reakciót a felfedezőjéről Stanislao Cannizzaroról nevezték el, ez a kémiai reakció ami egy bázis által indukált diszproporció, amiben egy aldehidből egy alkohol és egy karbonsav keletkezik. Cannizzaro ezt az átalakítást 1853-ban végezte el először, amikor benzaldehidet reagáltatott nátrium-hidroxiddal, és azt találta hogy benzil alkoholt és benzoesavat kapott!
Az oxidációs termék egy karbonsav és a redukciós termék egy alkohol. Azon aldehideknek amik alfa helyzetben tartalmaznak hidrogént, a karbonil szénhez képest (pl.: RCHR’CHO) a preferált reakció az aldol kondenzáció.
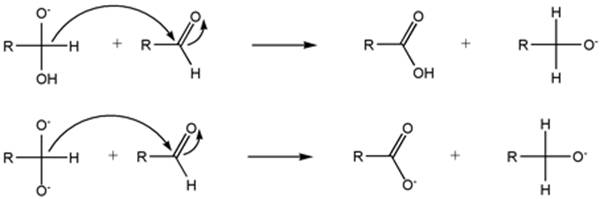
Reakció mechanizmusa: [1.]
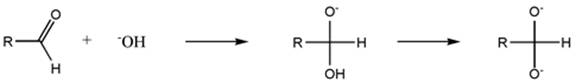
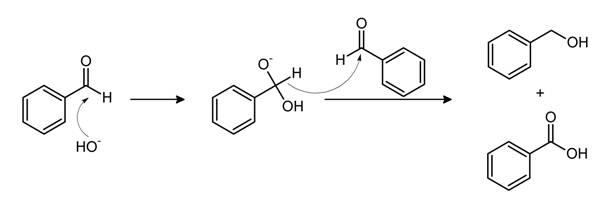
Az első lépésben egy nukleofil addíció, a bázisnak (ebben a példában az OH- anion) a karbonil szénre az aldehidben. Az így kapott alkoxid deprotonálódik, ezt a canizzarro köztiterméknek nevezzük. Ez egy dianion ami erősen bázikus tulajdonságú!
Mindkét köztitermék képes később az aldehidre hidrid aniont átadni. A hidrogén hidridanionként való lehasadását nagyban elősegíti, az hogy az alfa oxigének erős elektron küldő sajátságúak.A hidrid anion transzfer alatt egyenlő mennyiségben képződik a karboxil és az alkohol enolát formája!
sak azok az aldehidek amik nem tudnak keto-enol tautomériába menni képesek a Cannizzaro reakcióra! Mivel nincsen megfelelő helyen proton az enol formához. Ha erre képesek lennének akkor az aldol condenzáció menne végbe. Cannizzaro reakcióra jó molekulák, a formaldehid és az aromás aldehidek például a benzaldehid.
A Cannizzaro reakció alkalmazásai és módosításai
A Cannizzaro reakcióhoz, ha egy aldehidet és formaldehidet viszünk reakcióba tömény NaOH-al, akkor a megfelelő alkohol képződik az aldehidből és a formaldehidből hangyasav keletkezik.
[9] A kevert Cannizzaro reakciókban (Crossed Cannizzaro reactions) fel lehet állítani egy sort hogy melyik aldehidből lesz inkább több alkohol melyikből inkább több sav: Azonos körülmények között végzett reakcióban a kapott termékek aránya (molban):
Aldehid Sav1: Sav2 Alkohol1 : Alkohol2 Sav/alkohol 1 m-nitrobenzaldehid – furfural 1.19:1 1.28:1 1.20:1 2 p-Br-benzaldehid – Benzaldehid [8] 1.3:1 3 Furfural – p-Br-benzaldehid 1.47:1 1.27:1 1.33:1 4 Furfural – Benzaldehid [10] 1.69:1 5 m-Nitrobenzaldehid – Benzaldehid 1.82:1 1.72:1 1.79:1 6 Benzaldehid – p-anizaldehid 1.89:1 2.62:1 2.09:1 7 p-Br-benzaldehid – p-anizaldehid [8] 2.25:1 8 Furfural – p-anizaldehid 5.0:1 4.76:1 4.83:1
A fenti táblázat alapján értelmezni lehet hogy a gyűrűn lévő szubsztituensek hogyan befolyásolják a keletkező sav és alkohol arányát. A sor a fenti táblázatból a leginkább savképzővel és csökkenő sorrendben a redukálódott termékek irányába: m-nitrobenzaldehid > furfural > p-bróm-benzaldehid > benzaldehid > p-ánizsaldehid. [10]A sorból az látszik hogy annál inkább több sav képződik az adott kiindulási anyagból minél inkább dezaktivált a gyűrű.
A hidrid anion transzfer létét, és hogy a kapott alkoholon a szénhez kapcsolt hidrogén nem az oldószerből származik, úgy határozták meg hogy deuterált oldószerben (vízben) játszatták le a reakciót, és a kapott benzil-alkohol nem tartalmazott a szénen kapcsolt deutérium atomot. [2,3]
Bizonyos körülmények között benzyl-benzoátot mint elválasztható terméket is találtak az elegyben. [4]
Ezüst fém jelenléte gyorsítja a benzaldehidszármazékok átalakulását még azokét is amelyek normál körülmények között (pl.: o- vagy p-hidroxi-benzaldehid) nem reagálnak a Cannizzaro reakcióban [5], de ezüst hatására adják a reakciót [6,7]
[8] Ha alkoholt adunk az elegyhez az nem tolja el az egyensúlyt ( ő szerintük a legjobb kitermelést ezüst katalizátorra az alábbi körülményekkel lehetett elérni: 90ml oldószer, 0.0885mol benzaldehid, 0.0910mol NaOH, 5.18g ezüst, 75 oC-on, 60min kevertetve )
Irodalom
1. http://en.wikipedia.org/wiki/Cannizzaro_reaction
2. H. Fredenhagen and K. F. Bonhoeffer, Z. physik Chem., 181A, 379 (1938)
3. C. R. Hauser, P. J. Hamrick, Jr., and A. F. Stewart, J. Org. Chem., 21, 260 (1956)
4. T. A. Geissman, Org. Reactions, II, 94 (1944)
5. G. I. Kudryavtsev and E. A. Shilov, Dokl. Akad. Nauk SSSR, 64, 73 (1949); Chem. Abstr., 43, 4651 (1951)
6. I. A. Pearl, J. Am. Chem. Soc., 67, 1628 (1945)
7. I. A. Pearl, J. Org. Chem., 12, 89 (1947)
8. The Kinetics of the Silver Metal-catalysed Cannizzaro Reaction, Donald R. Lachowicz and Roy J. Gritter; J. Org. Chem. 28, 106, (1963)
9. Crossed Cannizzaro Reactions, Stewart E. Hazlet and Dale A. Stauffer; J. Org. Chem. 27, 2021, (1962)
10. S. E. Hazlet and R. B. Callison, ibid., 66, 1248 (1944)