Feladat
Három kémcsőben – ismeretlen sorrendben – szilárd nátrium karbonát, nátrium-klorid és alumínium-szulfát van. Desztillált víz és indikátorpapír segítségével azonosítsa a kémcsövek tartalmát! Értelmezze a változásokat reakcióegyenletek felírásával is!
Szükséges eszközök és anyagok:
| • műanyag tálca | • szilárd nátrium-karbonát | • hulladékgyűjtő |
| • 3 darab sorszámozott kémcső az ismeretlenekkel | • szilárd nátrium-klorid | |
| • kémcsőállvány | • szilárd alumínium-szulfát | |
| • csipesz | • indikátorpapír | |
| • desztillált víz |
Megfigyelések, tapasztalatok, következtetések
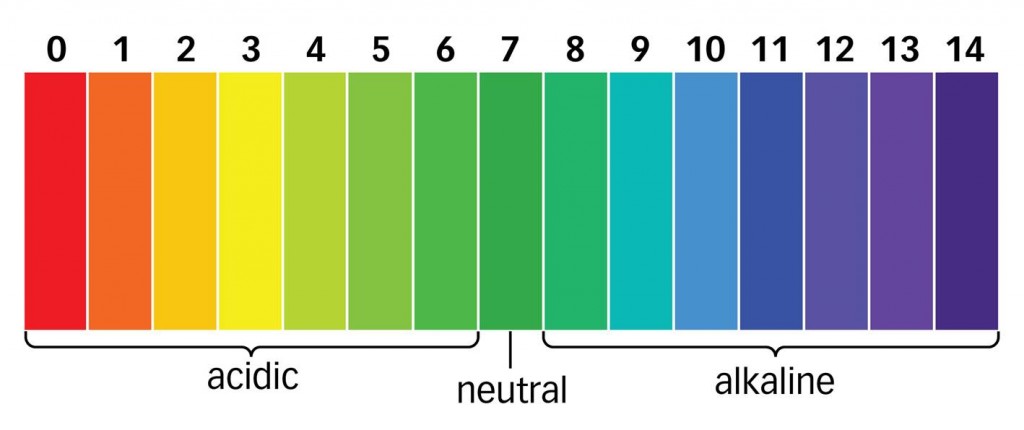
A kémcsövek tartalmához desztillált vizet adunk, enyhe rázogatással mindhárom kémcső tartalmát fel tudjuk oldani, ezért csak az oldódási viszonyokat figyelembe véve nem azonosíthatjuk az anyagunkat. 3db kis szelet univerzális indikátor papírt tépünk és a csipesz segítségével egyesével az oldatokba mártjuk, majd a színskála segítségével megállapítjuk a pH-t. A mi esetünkben elég azt tudni, hogy savas, semleges, vagy lúgos. Megfigyelésünk alapján megállapítottuk, hogy az 1. kémcső semleges, a 2. lúgos, a 3. savas kémhatású volt. Fontos tudnunk, hogy a nátrium-klorid semleges, a nátrium-karbonát lúgos, az alumínium-szulfát savas kémhatású, tehát az első kémcsőben nátrium-klorid, a másodikban nátrium-karbonát, a harmadikban alumínium-szulfát volt.
Az egyes anyagok oldhatósága vízben:
• Nátrium-karbonát (Na2CO3): 215 g/l (20 ºC-on)
• Nátrium-klorid (NaCl): 35.9 g/100³ (25 °C)
• Alumínium-szulfát {Al2(SO4)3.18H2O} 364 g/l
Reakcióegyenletek
A nátrium-klorid hidrolízise
NaCl(s) + H2O(l) → Na+(aq) + Cl–(aq)
A NaCl oldásakor csak disszociáció (+hidratáció) következik be, egyik ion sem reagál a vízzel → semleges pH.
A nátrium-klorid erős bázis (NaOH) erős savval(HCl) alkotott sója.
Az alumínium-szulfát hidrolízise
- lépés, disszociáció, hidratáció
Al2(SO4)3 + 12H2O = 2[Al(H2O)6]3+ + 3SO42-
- lépés, a központi atom taszító hatása miatt az egyik vízmolekula protont ad le, amit egy vízmolekula vesz fel
[Al(H2O)6]3+ + H2O → [Al(H2O)5(OH)]2+ + H3O+
Ebben az esetben az alumínium szulfát oldódásakor disszociáció következik be, és az alumínium taszító hatása miatt proton leadás is bekövetkezik → savas pH
Az alumínium-szulfát gyenge bázis (Al(OH)3) erős savval (H2SO4) alkotott sója
A nátrium-karbonát hidrolízise
- lépés disszociáció
Na2CO3(s) + H2O(l) = 2Na+(aq) + CO32-(aq)
- lépésben az anion reagál a vízmolekulával, hidroxid-ionok válnak szabaddá
CO32-(aq) + H2O(l) = HCO3–(aq) + OH–(aq)
Szabad hidroxid-ionok → lúgos pH
A nátrium-karbonát erős bázis (NaOH) gyenge savval (H2CO3) alkotott sója.